普克鲁胺生产的上市公司
普克鲁胺生产的上市公司
接下来具体说说
国产新冠特效药已有时间表 多家上市公司已布局

国产新冠特效药上市,已有了“时间表”。
据央视财经报道,目前我国自主研发的新冠特效药已有6种,其中4种进入Ⅲ期临床试验阶段,最快的一种有望12月上市。这也意味着,“疫苗+新冠特效药”齐头并进的防治策略将成为可能,将为我国乃至全球新冠疫情防控带来曙光。
据悉,有望下个月底获得批准附条件上市的新冠特效药,是由清华大学、深圳市第三人民医院和腾盛博药合作研发的新冠药物BRII-196和BRII-198联合用药,其在全球新冠特效药研发中优势明显。据科技日报报道,在国际上,已有同类型抗体药物获批紧急使用,美国再生元公司的中和抗体使住院及死亡率下降70%,葛兰素史克/Vir生物技术公司的中和抗体使住院及死亡率下降79%,但这两款中和抗体临床试验均不包含变异株数据,且入组受试者为确诊发病5—7日内的患者。相较而言,BRII-196和BRII-198的入组受试者为发病10日内,病情在体内发展了更长时间,治疗难度更大,依然得到78%的显著保护数据。
据清华大学医学院教授、全球健康与传染病研究中心主任张林琦对外表示,该抗体药物除在国内外开展的临床试验中展示出降低重症和死亡率78%的优异效果外,已在深圳、广州、云南、南京等疫情中对700多例感染者开展临床救治工作,“与欧美已获批紧急使用的新冠抗体药相比,我们是唯一进行了变异株感染者治疗效果评估并获得数据的。”
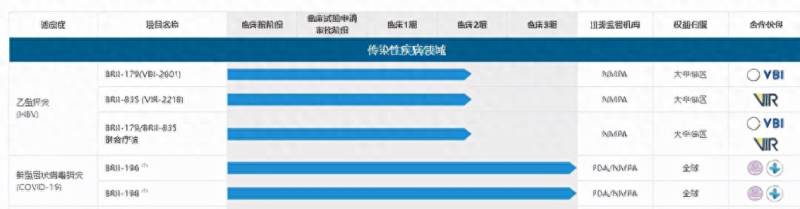
作为目前我国进展最快的抗体药物,BRII-196和BRII-198联合用药背后的上市公司腾盛博药也备受关注。成立于2017年的腾盛博药,是一家总部位于中国及美国的生物科技公司,致力于针对重大传染疾病或公共卫生疾病,如乙肝(HBV)、免疫缺陷病毒(HIV)、多重耐药(MDR)或广泛耐药性(XDR)革兰氏阴性菌感染,中枢神经系统(CNS)疾病等研究创新疗法,创始人是在生物制药行业拥有逾25经验的Hong博士。
2020年3月,通过公私合作形式,腾盛博药宣布与清华大学、深圳市第三人民医院合作并成立公司,共同开发SARS-CoV-2全人源单克隆中和抗体。2021年7月,腾盛博药在港交所上市。2021年10月9日,BRII-196和BRII-198联合用药的研发团队向国家药监局滚动提交附条件上市申报材料,有望12月底前获得批准(附条件)上市。
图源:腾盛博药官网
上市5个多月以来,腾盛博药股价波动较大。在今年9月下旬涨至高点的52.6港元/股随后下跌,于今年11月8日跌至低点的17.3港元/股。不过11月9日至11月26日港股收盘,腾盛博药出现连日上涨,累计涨幅已达143.61%,收于43.85港元/股。
研发已进入临床三期
为应对 COVID-19 新冠疫情,腾盛博药的子公司公司腾盛华创利用从新冠康复患者血清中筛选出的两个中和抗体BRII-196和BRII-198,开发出鸡尾酒疗法。这两种中和抗体,通过与新冠病毒 S蛋白上的受体结合区域(RBD)上不同表位的结合,来阻断其与人体细胞上的ACE2受体的结合,从而通过阻断病毒进入人体细胞。
招股书也显示,BRII-196及BRII-198鸡尾酒疗法具有作为SARS-CoV-2抗体疗法的潜力,用于治疗COVID-19,其具有更广的抗病毒谱(包括新出现的变种)以及长达六个月的保护。1期人用安全性及药代动力学(PK)研究表明,即使达到预期治疗剂量水平三倍,这些抗体依然具有安全性和耐受性。2021年6月,研发团队在中国启动BRII-196及BRII-198联合疗法的2期临床研究。
目前,BRII-196及BRII-198的联合疗法临床三期也已揭盲。据科技日报11月21日报道,新冠药物BRII-196和BRII-198联合用药临床三期已揭盲,给药组在治疗28天后实现零死亡,对照组8例死亡,详细结果会在近期对外公布。
公开资料显示,揭盲是指在盲法试验结束后,需要进行试验药和对照药的安全性疗效比较,这时就需要知道受试者具体使用的是哪个组别的,这个知道的过程就是揭盲。
由于在不到一年的时间内,将COVID-19的BRII-196/198鸡尾酒疗法从发现阶段推进至ACTIV全球政府赞助的2期╱3期主协议临床研究的后期开发阶段,给腾盛博药带来较高的成本支出。腾盛博药在招股书中表示,2020年企业研发开支出乎意料地高,于87.58亿元的总研发开支中,第三方合约成本中的53.55亿元涉及CMO生产BRII-196/198。
目前,由于产品尚未获准进行商业销售,腾盛博药尚未从产品销售产生收入,收入主要来源于政府补贴以及银行利息。2021年中期报显示,腾盛博药来自于政府补贴4566万元,以及银行利息62万元,合计获得其他收入4628万元,较去年同期的2285万元同比增长超一倍。对此,腾盛博药表示主要是来自政府补贴增长2460万,该等补贴主要来自**特别用于研发活动的奖励及其他补贴。
中泰国际在一份研报中表示,采用前沿技术在医药领域进行创新产品研发面临的极大的风险,因此腾盛博药采取自研及与第三方机构授权合作的模式,不仅能扩充自己的产品管线亦能分散研发风险。
多家上市公司已布局
据介绍,我国新冠病毒药物研发任务早在2020年1月21日由科技部部署应急研发专项布局开展。
2020年2月16日设立由科技部、卫生健康委、工信部、发改委、药监局、中医药局等部门组成的科研攻关组药物研发专班,组织全国优势专家团队,围绕临床救治需求,全力推进有效药物和治疗技术研发工作。据科技日报报道,目前临床救治与药物板块科研攻关应急项目已立项53项,涉及国拨经费约3.15亿元。
与此同时,在新冠病毒药物研发过程中,我国部署了3条技术路线。据相关负责人介绍,目前新冠病毒有效用药的研发主要围绕阻断病毒进入细胞、抑制病毒复制、调节人体免疫系统3条技术路线开展,我国在这些技术路线上均有部署。除腾盛博药与清华大学、深圳市第三人民医院研发的BRII-196和BRII-198联合用药外,目前,多种由我国研发团队自主研发的新冠肺炎有效药物已经用于临床救治中,而在这些项目背后,除博裕、红杉、云锋、高瓴资本等知名投资机构外,还出现复星医药、金域医学、爱博医疗、华大基因等上市公司身影。
公开资料显示,IPO之前,腾盛博药共进行过三轮融资,分别于2018年12月完成A轮融资8651万美元,2020年8月完成B轮融资1.72亿美元以及2021年3月完成C轮融资1.55亿美元,在这些投资机构中,包括云峰基金、红杉资本、通和毓承、博裕资本、ARCH Venture Partners和蓝池资本等投资机构投资。2021年中期报显示,红杉资本及沈南鹏,云锋基金等为腾盛博药股东。
而在此前,一种新的中和抗体也被批准为同情用药在北京地坛医院使用。在北京地坛医院,新冠感染者接受了我国自主研发的名为DXP-604的“同情用药”,使用后患者体内病毒载量大幅下降,憋喘、味嗅觉减退等症状明显好转,截至11月19日,已有17名患者顺利出院。据悉,该药是由北京大学谢晓亮团队与北京丹序生物制药有限公司(下称“丹序生物”)联合开发的中和抗体DXP604,由于有高达85%的重合位点,它使得人体细胞对于新冠病毒“拒不开门”。
与腾盛博药一样,丹序生物此前也拿到高瓴资本等多家知名投资机构投资。2020年9月,丹序生物宣布已完成近1亿元融资,该轮融资由高瓴创投、华盖资本联合领投,北京昌发展、*发展、天津汇智、薄荷基金跟投。天眼查资料显示,目前,珠海高瓴欣恒股权投资合伙企业(有限合伙)为丹序生物最大股东,持股比例为16.16%。
天眼查股权穿透还显示,北京华盖信诚远航医疗产业投资合伙企业(有限合伙)持有丹序生物14%的股份,而上市公司金域医学、复星医药通过北京华盖信诚远航医疗产业投资合伙企业(有限合伙)参股丹序生物。与此同时,北京昌科知衡一号创业投资合伙企业(有限合伙)持有北京丹序生物制药有限公司7%股份,通过天眼查股权穿透也可知,科创板上市公司爱博医疗、阳光诺和为北京昌科知衡一号创业投资合伙企业(有限合伙)股东。此外,其他参股丹序生物的上市公司还有丰原药业、华大基因以及先声药业。
在国际上,我国的新冠肺炎有效用药已在抗疫一线发挥着重要作用。资料显示,上市公司开拓药业在研的新一代雄激素受体拮抗剂“普克鲁胺”已经获得巴拉圭的紧急使用授权,其前期在巴西开展的三项临床试验初步表明,普克鲁胺能够将重症患者的死亡风险降低78%。
推荐国产抗新冠口服药获批上市
7月25日,国家药监局根据《药品管理法》相关规定,按照药品特别审批程序,进行应急审评审批,附条件批准河南真实生物科技有限公司阿兹夫定片增加治疗新冠病毒肺炎适应症注册申请。
国家药监局官网消息称,本品是我国自主研发的口服小分子新冠病毒肺炎治疗药物。2021年7月20日,国家药监局已附条件批准本品与其他逆转录酶抑制剂联用治疗高病毒载量的成年HIV-1感染患者。此次为附条件批准新增适应症,用于治疗普通型新型冠状病毒肺炎(COVID-19)成年患者。患者应在医师指导下严格按说明书用药。
国家药监局要求,上市许可持有人继续开展相关研究工作,限期完成附条件的要求,及时提交后续研究结果。
阿兹夫定情况跟踪
华尔街见闻此前提及,新冠小分子药物方面,国外仍以辉瑞Paxlovid为首要推广药物,国内来看主要以真实生物的阿兹夫定、君实生物的VV116、开拓药业的普克鲁胺进展较快。
6月30日,国家药品监督管理局药品审评中心“上市药品信息”公示了真实生物阿兹夫定片的申请上市技术审评报告及说明书。药监局官网信息显示阿兹夫定对《药品生产许可证》进行了变更,其生产厂家变更为河南真实生物科技有限公司、北京协和药厂有限公司两家,表明真实生物可委托其他药企生产阿兹夫定,而自身也已具备自行生产阿兹夫定的资质,引发市场高度关注。
7月15日,河南真实生物科技有限公司宣布,阿兹夫定治疗新型冠状病毒肺炎适应症注册Ⅲ期临床试验结果达到预期,近日已正式向国家药品监督管理局提交阿兹夫定治疗新型冠状病毒适应症的上市申请并获得受理,有望成为我国推荐具有完全自主知识产权的口服抗新冠药物。
据悉,支持本品上市申请的关键Ⅲ期注册临床试验,是采用多中心、随机、双盲、安慰剂对照的临床试验设计,临床试验结果显示:
(1)显著改善临床症状:阿兹夫定片可以显著缩短中度的新型冠状病毒感染肺炎患者症状改善时间,提高临床症状改善的患者比例,达到临床优效结果。首次给药后第7天临床症状改善的受试者比例阿兹夫定组40.43%,安慰剂组10.87%,具有极显著统计学差异(P值
(2)抑制新冠病毒作用:阿兹夫定具有抑制新冠病毒的活性,病毒清除时间为5天左右。
(3)安全性方面:阿兹夫定片总体耐受性良好,不良事件发生率阿兹夫定组与安慰剂组无统计学差异,未增加受试者风险。
以上就是普克鲁胺生产的上市公司的详细内容,希望通过阅读小编的文章之后能够有所收获!
