原子核结构模型是谁提出的?探索核物理的历史与发展
原子核结构模型是谁提出的
问题1:卢瑟福的原子核式结构模型的成功之处在哪里?正确地指出了原子核的存在,能很好地解释α粒子散射实验。问题2:经典电磁理论的困难是什么?无法解释原子的稳定性和原子光谱的分立特性。接下来具体说说探索核物理的历史与发展
原子核式结构的提出及其面临的困难
上一期我们谈到了卢瑟福用阿尔法粒子的散射实验,否定了汤姆逊的枣糕模型,从而提出了原子模型应该是原子核式结构模型。形象的说,该模型像一个太阳系,带正电的原子核像太阳,带负电的电子像绕着太阳转的行星。在这个“太阳系”,支配它们之间的作用力是电磁相互作用力。原子中带正电的物质集中在一个很小的核心上,而且原子质量的绝大部分也集中在这个很小的核心上。当α粒子正对着原子核心射来时,就有可能被反弹回去。这就圆满地解释了α粒子的大角度散射的现象。但是由于他还是用宏观的理论去解释微观的现象,所以就面临了一些困难,或者说是一些现象无法解释。最主要有两点无法解释,我们做一简要说明。
一是原子内部的电子不断向外辐射能量必然会导致电子轨道的缩小最终与原子核所带的正电子中和,事实并非如此。什么意思呢?,任何物体都在向外辐射能量,所以按照这个模型,电子向外辐射能量,那么,它的机械能就会减少,结合我们以前所学的圆周运动或者万有引力的模型,就可以知道它的轨道半径就会变小,如果一直变小,那么这个原子不就变小了吗?小到一定程度,原子核和电子不就是正负电子中和了吗?然而,事实并不是如此。
二是核式结构认为原子内部电子是做轨道运动,既然半径是慢慢变小,那么无法解释观测到的原子所发出的各种不连续的光谱的频率。这里我们简单说一下光谱,所谓的光谱,就是说任何一种物质都对应着一种光谱,也就是说对应着一种不同颜色的光带,或连续或不连续的光带。光谱如何观测呢?有两种方法,一种是让被观测的物质发光,借用一些专用仪器就可以观测到光谱,这称之为发射光谱,还有一种方法是用白光照射到被观测物质的蒸气上,有一部分光就被蒸气吸收了,这称之为吸收光谱。而这种结构恰恰无法解释这种不连续的光谱。怎么办呢?我们下期再说
一口气搞懂原子模型
之前我们聊到了拉瓦锡的“化学**”和道尔顿的“原子论”,这使得化学正式成为一门科学,随后门捷列夫的元素周期律横空出世,解决了一直悬而未决的元素排序问题。但其实一直有个问题还没有解决, 无论是拉瓦锡,还是道尔顿,亦或是门捷列夫,他们都没有真真切切地看到过原子。
那真的存在原子么?
这个问题放在现在其实并不难解决,你只要通过扫描隧道显微镜,就可以看到物质表面上单原子级别的起伏。不仅如此,你还可以在低温下利用探针尖端精确操纵单个分子或原子。
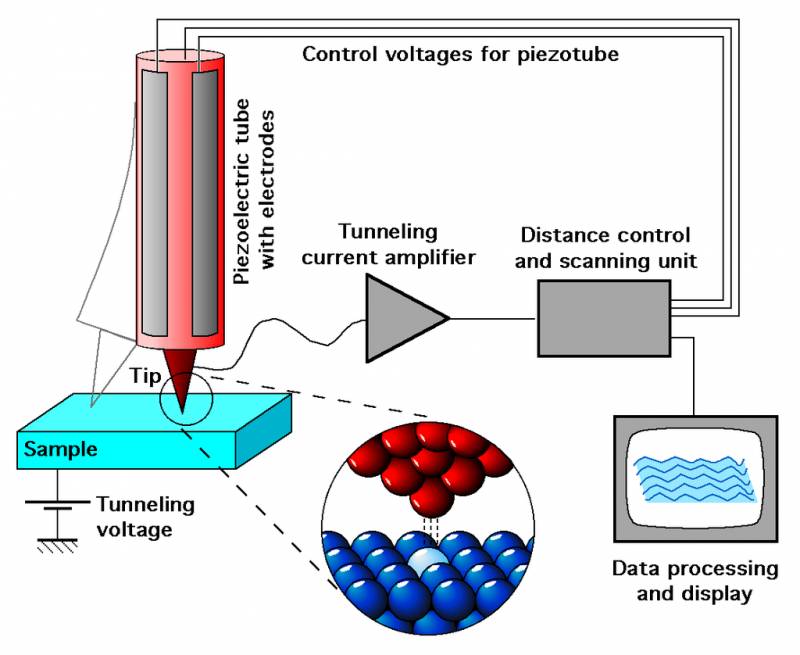
不过,这么高精尖的仪器是近几十年才有。可200多年前的的科学家是如何操作呢?
1827年,英国的植物学家 罗伯特·布朗 就在显微镜下观察到了水面上的花粉在不规则运动,这后来也被叫做 布朗运动 。1877年科学家 德绍儿克思 就提出,
花粉的运动是因为水中的水分子热运动造成的。

到了1905年, 爱因斯坦 通过数学分析的方法证明了布朗运动。

布朗运动间接证明了分子,原子的存在。并且根据布朗运动,还能计算出原子的直径大概为10^-8厘米。
原子到底长啥样?
除此之外,科学家还对原子到底长成什么样子特别感兴趣。只不过当时的科学家不知道,对于原子的研究竟然如此复杂和艰辛。
在这方面最先有成果的是物理学家 约瑟夫·汤姆孙 ,在研究阴极射线时,不仅发现了电子,还发现 电子是小于原子的存在 ,也就是说, 彻底打破了一直以来“原子不可再分”的设想。

于是, 约瑟夫·汤姆孙 就开始思考原子的模型。我们可以来现象一下 约瑟夫·汤姆孙 当时手头都知道哪些信息:
- 电子是负电的,小于原子的存在
- 原子是电中性
- 麦克斯韦电磁学理论
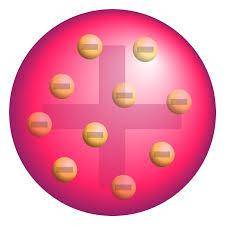
从这些信息中心, 约瑟夫·汤姆孙 最终构建了一个 梅子布丁模型 (也有叫枣糕模型、西瓜模型的)。在这个模型中,电子均匀镶嵌在整个原子上面。
为了验证老师的实验, 卢瑟福 在1909年,开始做α粒子轰击金箔的实验。
α粒子就是氦核,有两个质子和两个中子构成,带正电。卢瑟福就是拿氦核来当子弹去打金箔,然后记录散射的情况。
在大量的试验之后, 卢瑟福 发现有一部分的α粒子偏转角度要远远小于老师 约瑟夫·汤姆孙 的预测值。大概每8000多个α粒子就会有一个α粒子的移动方向发生很大的角度偏差,其他的α粒子都是直接穿过去去,偏转角度也就在2°到3°以内,甚至还有很多是没有偏转的。
于是,对于这样的实验结果,卢瑟福认为:
- 大部分的质量和正电荷是集中在一个很小的区域内的,这后来被叫做 原子核 。由于α粒子是带正电的,所以接近原子核时会产生很强的排斥力,才会以大角度发生偏转。
- 电子在这个区域之外,而不是镶嵌上在这个区域上的。
- 这个小区域(原子核)的尺度很小,应该要小于10^-14米。
然后, 卢瑟福 也提出了自己的原子模型。在这个原子模型中,电子在外面飘着,原子核带正电位于中心的位置,原子核的尺度很小很小,如果原子有个操场那么大,那么原子核也就是一只蚂蚁的大小。
但是 卢瑟福 的原子模型某种程度上来说,和 约瑟夫·汤姆孙 的原子模型结果是类似的。为什么这么说呢?因为根据麦克斯韦的电磁学理论,原子核外的电子在运动过程中会向外辐射电磁波,最终跌落到原子核中。所以,最后还是类似于 梅子布丁模型 。
为了解决这个问题, 卢瑟福 有个特别厉害的学生叫做 波尔 ,他就一直致力于解决这个问题,后来有个朋友跟他提起了巴尔末的氢原子光谱,波尔一下子豁然开朗。
所谓的巴尔末的氢原子光谱,其实是说,巴尔末发现氢原子所发射的光谱线在可见光有4个波长,波尔就猜想,
这四条光谱线应该就是吸收光子能量的电子在进入受激态后,又返回量子数n=2的量子态时所释放出来的谱线。
翻译成人话就是, 电子会吸收或者释放出特定的能量 。
于是,波尔提出了自己的原子模型。
在这个模型中,电子有自己轨道的能级轨道,电子会在轨道上跃迁,这个过程会吸收或者释放出特定的能量。波尔用这样办法去试图去解决电子会跌落到原子核的问题。
波尔的模型其实当时还是很受欢迎的,因为他的模型和太阳系特别像,物理学家特别热衷于统一,把微观和宏观进行统一更是了不得的大事。可惜,好久不长。波尔的模型用在氢原子还好,一旦外层电子数一多,这个模型就不太好用了。
接下来出场的是波尔的学生: 海森堡 。他就觉得他的老师在鬼扯,什么轨道,能级都是凭空假想出来的,物理学纯粹一点不好么?
1926年,海森堡建立了量子矩阵力学,并且提出了著名的 不确定性原理 。相关的描述就是:
粒子的位置与动量不可能同时被确定,位置的不确定性越小,则动量的不确定性越大,反之亦然。
也有把不确定性原理翻译成 测不准原理 ,说的就是我们没有办法同时测量到粒子的位置和动量。
根据海森堡的不确定性原理,电子在原子核的位置就比较奇葩了,我们已经没办法用确定性的来描述电子准确的位置,我们只知道它出现在某个位置的概率是多少。所以,电子在原子核外的分布是概率云的样式。电子自己也不知道自己到底下一刻会出现在哪里。
而根据海森堡不确定性原理推导而来的原子模型一直沿用至今,这也是目前科学界对于原子模型的主流看法。可以说,这是历经了4代的师生,将近30年的时间,才最终完成了原子模型的建立。
不过,科学家虽然对原子模型有了了解,但是电子带来的启示: 原子并非是不可再分 。也让科学家们开始思考,原子核或者电子是不是可以再继续往下分?那究竟是不是可以继续往下分呢?我们下期再继续聊。
高中物理:原子核式结构模型与经典电磁理论有哪些矛盾?
问题1:卢瑟福的原子核式结构模型的成功之处在哪里?
正确地指出了原子核的存在,能很好地解释α粒子散射实验 。
问题2:经典电磁理论的困难是什么?
无法解释原子的稳定性和原子光谱的分立特性。
问题3:按照教科书中经典电破理论对原子核式结构的分析结果,经典电碰理论包含常点基本内容?
当带电粒子做周期性运动,它的电磁场就周期性变化,而周期性变化的电磁场会向外发舟电磁波:发射出来的电破波的频率等于辐射体的频率。具体地讲, 在原子中,原子核外的电子将把它绕核转动的能量以电磁波的形式辐射出去;辐射电磁波的频率,就是电子绕核转动的频率。
问题4:原子中存在电磁场吗?如果存在,根据经典电磁理论它是由谁产生的?怎样变化?为什么?
原子中存在电磁场。电磁场是由运动的电子产生的,并做周期性变化。因为电子做周期性圆周运动时,形成了一个周期性变化的电磁场。
问题5:根据经典电磁理论,原子核外的电子会向外辐射电磁波即向外辐射能量吗?
由于电子的电磁场是周期性的,按照经典电磁理论,就要向外辐射电磁波。向外辐射电磁波的过程也就是向外辐射能量的过程,因此电子的能量要减少。
问题6:根据经典电磁理论,电子能量减少会导致什么结果?
根据经典电磁理论,电子能量减少会导致两个结果:
①原子不稳定
由于能量减少,电子的速度减小,库仑力将使其做近心运动,轨道半径连续减小,最终会落到原子核上,因而原子是不稳定的。计算表明,原子的“寿命”仅约为10-12s,这与原子是一个稳定系统的事实是根本矛盾的。
②原子光谱是连续谱
电子在转动过程中,随着转动半径的缩小,转动线速度不断增大,转动频率不断增大,照经典电磁理论,辐射电磁波的频率将不断增大,因而大量原子发光的光谱应该是连续谱。而事实上,原子光谱不是连续谱而是分立的线状谱,理论推导与事实矛盾。
问题7:原子核式结构模型与经典电磁理论的矛盾给予我们什么启示?
以上就是原子核结构模型是谁提出的?探索核物理的历史与发展的详细内容,希望通过阅读小编的文章之后能够有所收获!
